Centro Cardiovascolare
Azienda Sanitaria Universitaria Integrata di Trieste - (ASUI)


 Tra le cardiomiopatie, assieme alla cardiomiopatia dilatativa, la cardiomiopatia ipertrofica (CMPI) è la più frequente, con una prevalenza stimata di 1:500 persone. La cardiomiopatia ipertrofica è definita dalla presenza d’incremento di spessore del ventricolo sinistro (ipertrofia) in assenza di cause che potrebbero giustificare l’ipertrofia, come ad esempio il sovraccarico cronico di pressione (ipertensione arteriosa di lunga durata o stenosi valvolare aortica) o forme infiltrative/malattie da accumulo (malattia di Fabry o amiloidosi). La malattia si può manifestare in qualunque fascia di età, con penetranza ed espressività clinica variabile, da clinicamente asintomatica, allo scompenso cardiaco diastolico e, in rari casi, sistolico (fase dilatativo-ipocinetica) fino alla morte improvvisa.
Tra le cardiomiopatie, assieme alla cardiomiopatia dilatativa, la cardiomiopatia ipertrofica (CMPI) è la più frequente, con una prevalenza stimata di 1:500 persone. La cardiomiopatia ipertrofica è definita dalla presenza d’incremento di spessore del ventricolo sinistro (ipertrofia) in assenza di cause che potrebbero giustificare l’ipertrofia, come ad esempio il sovraccarico cronico di pressione (ipertensione arteriosa di lunga durata o stenosi valvolare aortica) o forme infiltrative/malattie da accumulo (malattia di Fabry o amiloidosi). La malattia si può manifestare in qualunque fascia di età, con penetranza ed espressività clinica variabile, da clinicamente asintomatica, allo scompenso cardiaco diastolico e, in rari casi, sistolico (fase dilatativo-ipocinetica) fino alla morte improvvisa.
La CMPI è una malattia geneticamente determinata e trasmessa con modalità mendeliana autosomica dominante. è possibile identificare una mutazione in circa il 60% dei casi di CMPI. I geni più frequentemente coinvolti sono quelli del sarcomero9, le cui mutazioni sono presenti in circa il 60% dei casi di CMPI.
Le mutazioni a carico dei geni che codificano per la beta-myosin heavy chain (MYH7) e per la myosin-binding protein C (MYBPC3) costituiscono le varianti più frequenti. Meno comuni sono le mutazioni a carico dei geni che codificano per cardiac troponin I and T (TNNI3, TNNT2), tropomyosin alpha-1 chain (TPM1) e myosin light chain 3 (MYL3) e per l’actina (ACTC) Alcuni studi hanno dimostrato che i pazienti con mutazioni a carico delle proteine sarcomeriche manifestano la malattia in età più precoce e hanno una più alta incidenza di storia familiare di CMPI e morte improvvisa cardiaca, rispetto a quelli senza una mutazione identificata. Inoltre tendono a manifestare un’ipertrofia, più severa, disfunzione microvascolare e fibrosi miocardica. Dati recentemente pubblicati, suggeriscono che multiple mutazioni a carico dei geni sarcomerici sono presenti in circa il 5% degli individui, e tendono a manifestare la malattia età più precoce e con un fenotipo più severo.
Alcune mutazioni del gene MYH7 correlano con un rischio aumentato di morte improvvisa, mentre le mutazioni del gene MYBPC3 sono associate ad un esordio più tardivo della malattia. Le mutazioni del gene TNNT2 sono correlate con un maggiore rischio di morte improvvisa nei giovani adulti, anche con solo lieve ipertrofia18, mentre alcune mutazioni del gene ACTC sono legate a forme di HCM con limitato coinvolgimento apicale.
Dai dati pubblicati sembra che alcune proteine sarcomeriche siano associate a una prognosi più severa, ma questi studi osservazionali sono basati su piccoli gruppi di pazienti e talvolta non sono dati riproducibili e risentono del limite dovuto alla rarità delle mutazioni. Alcuni studi suggeriscono che multiple mutazioni a carico dei geni sarcomerici sono presenti in circa il 5% degli individui, e tendono a manifestare la malattia età più precoce e con un fenotipo più severo.
La diagnosi differenziale è utile per distinguere la CMPI da altre forme d’ipertrofia cardiaca e guidare la ricerca genetica. Disordini metabolici (malattia di Anderson-Fabry, sindrome PRKAG2), mitocondriopatie, malattie neuromuscolari (atassia di Friedreich), sindromi malformative (sindrome di LEOPARD, Costello) e malattie infiltrative (amiloidosi) sono tutte causa di ipertrofia ventricolare sinistra e vanno considerate in presenza di fenotipi suggestivi. La ricaduta clinica nell’identificare la malattia di Fabry è l’introduzione di terapia enzimatica sostitutiva. Recenti trial clinici, basati sui dati incoraggianti su modelli animali, stanno studiando l’utilizzo di farmaci in grado di ridurre il grado d’ipertrofia.
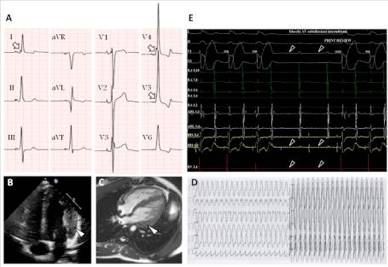
Un approccio per red flags è importante e permette di guidare anche la ricerca genetica saper riconoscere alcuni segni patognomonici permette di riconoscere fenocopie che altrimenti verrebbero classificate come CMPI , ecco perché è fondamentale una continua integrazione tra genetista e cardiologo clinico, per poter fare diagnosi adeguate di forme non così scontate.
Le immagini nel panel riportano il caso di un 17 enne, il cui padre ha un’ipertrofia inspiegata ed è portatore di pacemaler dall’età di 35 anni per sick sinus syndrome. Il suo ECG mostra importanti segni di ipertrofia e preeccitazione ventricolare. L’ecocardio mostrava un ipertrofia lieve asimmetrica postero laterale. Pochi mesi dopo si è recato in PS per una TPSV sostenuta, successivamente sottoposta ad ablazione dopo studio elettrofisiologico.
L’analisi genetica non ha rilevato mutazioni sarcomeriche, mentre si è identificata una mutazione missense del gene (PRKAG2) Arg302Glu. Questa è una patologia caratterizzata da ipertrofia ventricolare sinistra. Preeccitazione ventricolare, aritmie ventricolari e sopraventricolari, blocchi AV avanzati e scompenso cardiaco e morte improvvisa.
PRKAG2 disease is an autosomal dominant and fully penetrant syndrome characterized by a wide early-onset clinical spectrum encompassing LVH, VPE, supra-ventricular and ventricular arrhythmias, advanced heart blocks, heart failure and sudden cardiac death (SCD).

Conclusioni:
Gran parte delle forme di CMPI è determinata da mutazioni di geni sarcomerici, ma esistono fenocopie in cui la diagnostica genetica ha importanti ricadute prognostico-terapeutiche: ad esempio Fabry e PRKAG2 Syndrome Mialgie diffuse, lentigini diffuse, cornea verticillata: pensa a Fabry Segni ECG di pre-eccitazione, discrepanza tra alti voltaggi ECG e lieve -moderata IVS all’eco con PR breve: pensa a PRKAG2 , o a Danon nei pazienti di giovane età con massiva ipertrofia PRKAG2 : il problema sono le bradi-tachiartimie, con indicazioni a impianto PM nella quasi totalità dei casi ( mut arg3012gln)
|
|