Centro Cardiovascolare
Azienda Sanitaria Universitaria Integrata di Trieste - (ASUI)


Medico Specializzando e Cardiologo/Medico dello Sport presso Azienda Sanitaria Universitaria Integrata di Trieste
Nella pratica clinica, non sempre è facile distinguere ciò che è il fisiologico adattamento all'attività sportiva da una malattia del muscolo cardiaco.
 Il termine “cuore d’atleta” definisce un insieme di cambiamenti strutturali e funzionali che il cuore sviluppa in risposta all’esercizio fisico.
Il termine “cuore d’atleta” definisce un insieme di cambiamenti strutturali e funzionali che il cuore sviluppa in risposta all’esercizio fisico.
Resistenza e forza sono le componenti distintive di un’attività fisica e determinano differenti sollecitazioni e variazioni emodinamiche a carico del sistema cardiovascolare.
Gli sport di resistenza come la corsa o il ciclismo, inducono un aumento dell’output cardiaco per incremento della frequenza cardiaca e dello stroke volume, riducendo le resistenze periferiche con moderato incremento della pressione sistemica.
Gli sport di forza, ad esempio il sollevamento pesi, sono caratterizzati da un output cardiaco che rimane invariato, mentre le resistenze periferiche aumentano.
Negli sport di resistenza il rimodellamento ventricolare sinistro è tipicamente caratterizzato da un ingrandimento della camera ventricolare con un’ipertrofia eccentrica delle pareti. Esercizi di forza portano invece a un’ipertrofia concentrica con una camera ventricolare che si mantiene di normali dimensioni. Tuttavia questa visione dicotomica non è sempre rispettata, soprattutto quando un atleta svolge un’attività sportiva che coniuga forza e resistenza come nel caso del canottaggio, rugby o hockey.
Il ventricolo destro risponde alla resistenza andando incontro a dilatazione, mentre sembra che discipline di forza, siano meno influenti sulle dimensioni del ventricolo destro, che molto spesso si mantengono normali.
Occorre considerare inoltre, che il rimodellamento cardiaco risente dell’influenza anche di altri fattori oltre all’esercizio come la genetica, il sesso e la razza, tutti elementi da tenere presenti nella valutazione degli atleti.
Nella pratica clinica, non sempre è facile distinguere ciò che è il fisiologico adattamento all’attività sportiva da una malattia del muscolo cardiaco. L’imaging cardiovascolare con le diverse metodiche di cui dispone, può aiutare il cardiologo a fare chiarezza in condizioni cliniche di difficile interpretazione.
La valutazione del ventricolo sinistro
L’esame ecocardiografico è sicuramente la prima metodica che entra in campo nella valutazione morfologica e funzionale delle camere cardiache e in questo caso, del ventricolo sinistro.
Le dimensioni delle camere ventricolari, gli spessori parietali, la massa, la funzione sistolica e diastolica sono i principali elementi che permettono di discriminare se ciò che stiamo valutando ha le caratteristiche di un cuore sano.
Negli atleti ad esempio, il diametro telediastolico ventricolare sinistro raramente è maggiore ai 60 mm, se così fosse e in particolare se associato a una riduzione della frazione d’eiezione e a un alterato rilasciamento diastolico, dovrebbe porre il sospetto di una cardiomiopatia dilatativa. Inoltre negli atleti, l’ipertrofia ventricolare sinistra coinvolge tutti i segmenti miocardici con uno spessore del setto generalmente inferiore ai 12 mm. Nella cardiomiopatia ipertrofica, l’ipertrofia parietale, spesso maggiore ai 15 mm, coinvolge principalmente il setto basale e nel 20% dei casi è associata ad altre caratteristiche, quali ad esempio il SAM (systolic anterior motion) della valvola mitrale. Altro elemento che distingue la cardiomiopatia ipertrofica da un’ipertrofia secondaria a esercizio è la mancata riduzione degli spessori parietali dopo decondizionamento fisico di almeno 3 mesi, come invece si rileva negli atleti sani.
E’ da tenere presente che negli atleti di sesso femminile lo spessore del setto è più basso rispetto agli atleti maschi e che nella razza nera si hanno spessori parietali più pronunciati rispetto ai caucasici.
Negli atleti la massa ventricolare sinistra è aumentata e può associarsi a una funzione di pompa normale a riposo, mentre lo stroke volume può essere normale o lievemente aumentato. Il Doppler pulsato tissutale fornisce ulteriori informazioni nella valutazione delle performance della funzione sistolica a riposo in un atleta. Una velocità di S’ inferiore a 9 cm/s è stato dimostrato avere l’ 87% di sensibilità ed il 97% di specificità nel distinguere un’ipertrofia ventricolare sinistra patologica da un’ipertrofia da cuore d’atleta. Negli atleti inoltre, la funzione diastolica ventricolare sinistra a riposo potrebbe essere normale, ma molto spesso è sopranormale quando comparata con individui non allenati. Tipicamente, il rapporto E/A è maggiore a 2 negli atleti che presentano anche un incremento della velocità di e’ con un basso rapporto E/e’, mentre nella cardiomiopatia ipertrofica è E/A è inferiore ad 1, il tempo di decelerazione dell’onda E è prolungato con una bassa velocità di e’ ed un basso rapporto e’/a’.
Tuttavia un normale pattern di riempimento diastolico del ventricolo sinistro non esclude un’ipertrofia ventricolare sinistra patologica.
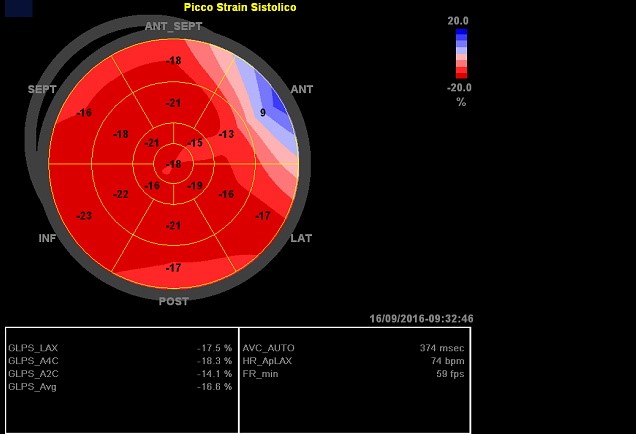
Recentemente anche lo speckle traking ha trovato spazio nella valutazione degli atleti al fine di distinguere un’ipertrofia ventricolare sinistra fisiologica da una patologica. Si è visto che una lieve riduzione dello strain globale longitudinale a riposo è compensata da un incremento dello strain radiale e circonferenziale nei giocatori di calcio professionisti, mentre nei ciclisti è stato evidenziato un basso strain radiale apicale a riposo rispetto ai controlli. Questi studi suggeriscono un adattamento del ventricolo sinistro anche alle condizioni di riposo e sottolineano la dipendenza delle misure di strain al carico di lavoro. Il cuore d’atleta si presenta quindi come un interessante modello di variazione dello strain indotto dall’attività fisica. Allo scopo di identificare i differenti pattern di rimodellamento ventricolare sinistro a seconda del tipo di esercizio svolto, che sia di resistenza, forza o entrambi, un approccio che appare promettente prevede l’utilizzo dello strain 2D associato alla valutazione dei volumi mediante il 3D. Attualmente l’applicazione dello speckle traking nella valutazione degli atleti è supportata solamente da risultati preliminari e l’utilizzo di tale metodica non è indicato nella pratica clinica.
Un approccio di secondo livello nella valutazione del ventricolo sinsitro, si ha con l’utilizzo della risonanza magnetica. Le immagini sono acquisite in tutti i piani tomografici senza limitazioni derivanti dall’habitus dell’atleta, definisce con un alto grado di dettaglio la morfologia, le dimensioni e la funzione delle camere cardiache, quantifica la contrazione e il rilasciamento ventricolare mediante le misurazioni dello strain miocardico, visualizza e quantifica la perfusione miocardica e permette la caratterizzazione del tessuto miocardico, infatti è in grado di identificare la presenza di fibrosi mediante l’utilizzo di Gadolinio nelle sequenze di late enhencement (LGE). Il pattern di distribuzione del LGE permette l discriminazione un miocardio ischemico da uno non ischemico con importanti implicazioni terapeutiche. Nella necrosi post infarto ad esempio, il LGE avrà una distribuzione subendocardica o transmurale, nell’amiloidosi la distribuzione è subendocardica ad anello, mentre un enhancement a chiazze è tipico della cardiomiopatia ipertrofica, nelle miocarditi è epicardico o intramurale.
Una nuova promettente metodica di risonanza magnetica è il T1 mapping, che permette di evidenziare la presenza di fibrosi che sfugge all’indagine mediante LGE utilizzando le sequenze T1 native (senza contrasto) oppure attraverso la misurazione diretta della frazione di volume extracellulare, ossia di quella parte di tessuto miocardico privo di cellule, pre e post iniezione di mezzo di contrasto.
Tuttavia il costo della metodica e la ridotta disponibilità, rendono la risonanza magnetica un’indagine di secondo livello e viene utilizzata quando l’ecografia non è stata dirimente nel definire una diagnosi. Inoltre, se per l’ecocardiografia abbiamo valori di normalità che sono stati ricavati da ampie popolazioni di atleti che differiscono sia per etnia che per disciplina sportiva praticata, i valori definiti normali di risonanza magnetica derivano invece da studi condotti in pochi centri, coinvolgenti un numero inferiore di atleti.
L’atrio sinistro
L’ingrandimento atriale sinistro secondario all’aumento di pressione in questa cavità durante esercizio fisico, è un reperto comune in ampie corti di atleti.
Il primo approccio strumentale per la valutazione dell’atrio sinistro avviene con l’ecocardiografia. Si consiglia di applicare il metodo area- lunghezza o Simpson modificato per la misurazione 2D dei volumi atriali, i quali andrebbero indicizzati per la superficie corporea, preferendo tale metodica ai diametri lineari antero- posteriori. Tuttavia, mentre il limite superiore di 45 mm per le donne e 50 mm per gli uomini è ben definito negli atleti con le misurazioni ottenute mediante i diametri, non lo è per il metodo del volume indicizzato. Le linee guida definiscono come limite superiore i 34 mL/m2, ma in realtà, non esiste ancora un range di normalità per gli atleti, che dovrebbe considerare l’influenza di fattori quali l’etnia, il genere e l’età.
L’applicazione dello speckle traking per la valutazione della funzione dell’atrio sinistro ha evidenziato che questa è aumentata negli atleti e ridotta nei soggetti con cardiomiopatia ipertrofica, ma è ancora prematuro raccomandare l’utilizzo di questo parametro nella pratica clinica. Poiché l’ecocardiografia tende a sottostimare i volumi atriali, la risonanza magnetica può essere una metodica di indagine alternativa. Recenti studi di risonanza hanno dimostrato che nonostante i volumi di entrambi gli atri siano maggiori negli atleti, non vi sono differenze significative rispetto ai controlli, quando i dati vengono normalizzati per il volume totale del cuore.
Le camere destre
L’ecocardiografia anche in questo caso, è la prima scelta per la valutazione del ventricolo destro dell’atleta. Valori normali dello spessore parietale sono definiti inferiori a 0,5 cm, misurati da approccio sottocostale o parasternale asse lungo.
Un ingrandimento ventricolare destro dovrebbe essere identificato misurando almeno il diametro del ventricolo destro alla base e il diametro che va dalla base all’apice del ventricolo destro da approccio apicale 4 camere.
Alcune modificazioni a carico del ventricolo destro presenti in atleti che svolgono attività fisica che richiede un’alta prestazione di resistenza possono assomigliare molto a quelle che si trovano nella displasia aritmogena del ventricolo destro. Nella displasia aritmogena, la dilatazione del ventricolo destro coinvolge sia il tratto di efflusso che di afflusso e può essere associata ad alterazioni morfologiche ( aneurismi, assottigliamenti o trabecolature) e funzionali (alterazioni della cinetica segmentaria). La displasia aritmogena può coinvolgere anche il ventricolo sinistro. Negli atleti l’ingrandimento ventricolare destro interessa il tratto di afflusso e spesso si associa a dilatazione ventricolare sinistra (dilatazione bilanciata) ma la funzione sistolica del ventricolo destro, valutata mediante il tricuspidal plane systolic excursion (TAPSE) è normale o talvolta supernormale.
Nei soggetti con una finestra acustica subottimale o nei casi di difficile interpretazione, la risonanza magnetica diventa la metodica di riferimento, permettendo di evidenziare alterazioni della cinetica segmentaria o la presenza di microaneurismi al tratto di efflusso. La risonanza magnetica è in grado di rilevare anche la sostituzione fibro- adiposa sia del ventricolo destro che del sinistro, ma attualmente non è considerata un criterio diagnostico per displasia aritmogena. Occorre ricordare che non vi è un indicatore patognomonico di displasia aritmogena per cui la diagnosi differenziale deve considerare la combinazione di più fattori quali la presentazione clinica, la storia familiare ed i reperti elettrocardiografici, oltre che all’imaging.
La ricerca di ischemia miocardica e la definizione dell’anatomia coronarica
Il clinico ha a disposizione differenti metodiche di imaging che permettono di identificare la presenza di un’anomalia coronarica congenita o di malattia coronarica negli atleti.
L’ecocardiografia: l’ostio coronarico è visibile nel 90-92% degli atleti ed è quindi possibile identificare un’origine anomala delle coronarie con un’alta specificità. Tuttavia non vi sono studi che dimostrino la sensibilità dell’ecocardiografia nell’identificare un’origine anomala delle coronarie.
L’ecocardiografia da stress: fornisce informazioni in merito alla funzione cardiaca, alla riserva contrattile, alla capacità di esercizio e sulla presenza di eventuali aritmie. La malattia coronarica può essere diagnosticata con questa metodica con una sensibilità di circa il 76% ed una specificità dell’88%, ma l’esame può essere del tutto normale in presenza di origine anomala delle coronarie. E’ utile in quegli atleti che presentano una funzione di pompa < 45% a riposo, se questa migliora durante esercizio si può pensare che la ridotta funzione a riposo sia correlata ad una riduzione del pre- carico piuttosto che ad una disfunzione del ventricolo sinistro.
Medicina nucleare: esistono dati veramente limitati in merito all’applicazione della SPECT e della PET nella valutazione della perfusione negli atleti. Queste metodiche hanno un ruolo prevalentemente di ricerca e non vengono utilizzate nella pratica clinica quotidiana.
TC coronarica: permette sia la valutazione dell’anatomia coronarica, sia di un’eventuale presenza di malattia coronarica mediante la quantificazione del calcio depositato nelle coronarie, tuttavia non è raccomandata nella valutazione di primo livello degli atleti.
Risonanza magnetica di perfusione da stress: può aiutare nella diagnosi di malattia coronarica negli atleti come nella popolazione generale, ma sono ancora molto pochi gli studi che hanno applicato questa metodica negli atleti o nei pazienti con cardiomiopatia ipertrofica. Con la risonanza magnetica da stress, nei pazienti con cardiomiopatia ipertrofica si è rilevata una significativa riduzione della perfusione miocardica e che era direttamente proporzionale al grado di ipertrofia, gli atleti invece presentavano una perfusione normale. La risonanza da stress trova indicazione nei casi che presentano un dubbio diagnostico che non si è riusciti a dirimere mediante altre tecniche di imaging.
Per quanto riguarda l’origine delle coronarie, essa è finemente evidenziabile con l’angiografica coronarica mediante risonanza, da riservare agli atleti di età < ai 35 anni con un basso rischio di malattia coronarica.
Conclusioni
L’imaging cardiovascolare svolge un ruolo importante nell’identificare se nel cuore d’atleta si cela una malattia cardiaca, ma l’utilizzo dell’imaging deve essere sempre integrato con la storia clinica, l’intensità degli allenamenti, i sintomi, l’età, il genere, l’ECG o l’eventuale indagine genetica.
Figure e tabelle utili nella pratica clinica
Misure ecocardiografiche da eseguire nella valutazione degli atleti
Eur Heart J Cardiovasc Imaging. 2015;16 :353
Caratteristiche ecocardiografiche distintive di cuore d’atleta rispetto a una cardiomiopatia. (LV GLS:Left ventricle Global Longitudinal Strain). F1000Res. 2015 Jun 15;4:151
Algoritmo per la diagnosi differenziale tra cuore d’atleta e cardiomiopatia ipertrofica o dilatativa proposto dall’ European Association of Cardiovascular Imaging.
Eur Heart J Cardiovasc Imaging. 2015;16 :353
Algoritmo per la diagnosi differenziale tra cuore d’atleta e displasia aritmogena del ventricolo destro e per la diagnosi di malattia coronarica negli atleti, proposto dall’ European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16 :353
Bibliografia
Nagueh SF, Zoghbi WA. JACC Cardiovasc Imaging. 2015;8 :828-45.
Echocardiography in the evaluation of athletes.
Grazioli G, Sanz M, Montserrat S, Vidal B, Sitges M. F1000Res. 2015 Jun 15;4:151
The multi-modality cardiac imaging approach to the Athlete's heart: an expert consensus of the European Association of Cardiovascular Imaging.
Galderisi M, Cardim N, D'Andrea A, Bruder O, Cosyns B, Davin L, Donal E, Edvardsen T, Freitas A, Habib G, Kitsiou A, Plein S, Petersen SE, Popescu BA, Schroeder S, Burgstahler C, Lancellotti P. Eur Heart J Cardiovasc Imaging. 2015;16 :353.
Exercise-Induced Left Ventricular Remodeling Among Competitive Athletes: A Phasic Phenomenon.
Weiner RB, DeLuca JR, Wang F, Lin J, Wasfy MM, Berkstresser B, Stöhr E, Shave R, Lewis GD, Hutter AM Jr, Picard MH, Baggish AL. Circ Cardiovasc Imaging. 2015 Dec;8(12). pii: e003651.
American College of Cardiology Foundation Task Force on Expert Consensus Documents., Hundley WG, Bluemke DA, Finn JP, Flamm SD, Fogel MA, Friedrich MG, Ho VB, Jerosch-Herold M, Kramer CM, Manning WJ, Patel M, Pohost GM, Stillman AE, White RD, Woodard PK.
J Am Coll Cardiol. 2010;55:2614-62.
Myocardial tissue characterization using magnetic resonance noncontrast T1 mapping in hypertrophic and dilated cardiomyopathy. Dass S, Suttie JJ, Piechnik SK, Ferreira VM, Holloway CJ, Banerjee R, Mahmod M, Cochlin L, Karamitsos TD, Robson MD, Watkins H, Neubauer S. Circ Cardiovasc Imaging 2012;5:726–33.
Cardiac magnetic resonance assessment of left and right ventricular morphologic and functional adaptations in professional soccer players. Scharf M, Brem MH, Wilhelm M, Schoepf UJ, Uder M, Lell MM. Am Heart J 2010;159:911 – 8.
Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. Rudski LG, Lai WW, Afilalo J, Hua L, Handschumacher MD, Chandrasekaran K et al. J Am Soc Echocardiogr 2010;23:685 – 713.
|
|