Centro Cardiovascolare
Azienda Sanitaria Universitaria Integrata di Trieste - (ASUI)


Fonte: Gianni Pedrizzetti
Gianni Pedrizzetti
Dipartimento Ingegneria e Architettura, Università di Trieste
PREMESSA CLINICA. La sindrome clinica dello scompenso cardiaco è la patologia cardiaca progressiva più diffusa, che si presenta sia come disfunzione primaria sia come conseguenza di ogni altra disfunzione nonché a seguito di interventi terapeutici. Lo scompenso ha come primo e visibile effetto il rimodellamento del ventricolo sinistro: un aumento progressivo del volume della camera cardiaca che porta ad un rapido peggioramento della sua funzionalità tale che il tasso di sopravvivenza a 5 anni a seguito di una diagnosi di scompenso risulta di poco superiore al 50%.
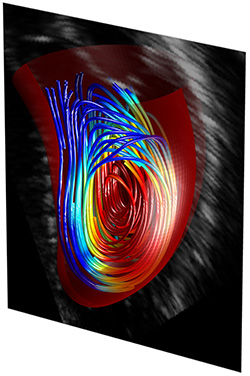 PREMESSA FLUIDODINAMICA. Il flusso del sangue all’interno del ventricolo sinistro è caratterizzato dalla presenza di un vortice che guida il moto lungo traiettorie curve dall’ingresso mitralico verso l’uscita aortica percorrendo l’intera cavità ventricolare (Figura 1), in un processo che in condizioni fisiologiche garantisce un efficiente ricambio di sangue. Dal punto di vista dinamico, la peculiarità di questo processo consiste nella presenza di elevate accelerazioni, e quindi forze, dovute a rapide variazioni nella direzione e nell’intensità della velocità del sangue.
PREMESSA FLUIDODINAMICA. Il flusso del sangue all’interno del ventricolo sinistro è caratterizzato dalla presenza di un vortice che guida il moto lungo traiettorie curve dall’ingresso mitralico verso l’uscita aortica percorrendo l’intera cavità ventricolare (Figura 1), in un processo che in condizioni fisiologiche garantisce un efficiente ricambio di sangue. Dal punto di vista dinamico, la peculiarità di questo processo consiste nella presenza di elevate accelerazioni, e quindi forze, dovute a rapide variazioni nella direzione e nell’intensità della velocità del sangue.
RAZIONALE. Gli attuali modelli predittivi della progressione del rimodellamento ventricolare non tengono in alcun conto la presenza del sangue all'interno della camera cardiaca. Il sangue è un materiale incomprimibile, con lo stesso peso del tessuto, pertanto esso mette in contatto i diversi segmenti del miocardio attraverso la colonna di fluido tra di essi. In presenza di un flusso vorticoso intraventricolare, la comunicazione tra regioni lontane viene modulata attraverso il regime di moto cosicché l'inerzia associata alla rapida accelerazione-decelerazione in prossimità dei tessuti può dar luogo a sollecitazioni differenziali sui diversi segmenti.
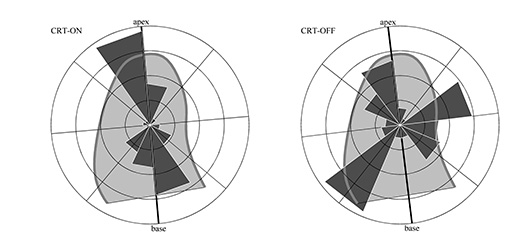
La sequenza fisiologica di attivazione-rilasciamento nei segmenti miocardici determina la distribuzione temporale dei gradienti di pressione intracavitari. Nei soggetti normali, il movimento del sangue è associato ad una distribuzione di spinte dinamiche che è principalmente orientata lungo la direzione di base-apice in perfetta conformità col meccanismo di riempimento-svuotamento del ventricolo. Questo comportamento si sposa perfettamente con una geometria composta da apice molto curvo e pareti laterali più rettilinee, e assicura una corretta interazione tra il flusso di sangue e i tessuti del miocardio per una distribuzione equilibrata degli sforzi lungo le pareti. Questo è esemplificato in Figura 2 (sinistra), dove un istogramma polare rappresenta la naturale distribuzione direzionale delle pressioni intracavitarie durante l'intero ciclo cardiaco. In numerose patologie, la sequenza di contrazione e rilasciamento dei segmenti miocardici perde la naturale sincronia e porta allo sviluppo di un errato flusso vorticoso intraventricolare. Quest’ultimo genera un disallineamento dello scambio dinamico di forze tra sangue e tessuto e porta alla nascita di sollecitazioni su segmenti errati ed in momenti inopportuni durante il ciclo cardiaco. Ad esempio, se un segmento si contrae anticipatamente rispetto ad un altro, la forza generata dal primo imprime una spinta sul secondo, ancora inattivo, anziché essere sfruttata per l’eiezione in aorta; parimenti un’iniziale rigidità di un segmento durante il rilasciamento provoca la deviazione del flusso in ingresso verso un’altra regione che viene così sottoposta ad un inatteso incremento di carico.
La nascita di spinte trasversali, non funzionali al processo di riempimento-svuotamento ventricolare, suscita un adattamento fisiologico, per esempio attraverso meccanismi di trasduzione meccanica che inducono processi di genomica e proteomica, con il conseguente sviluppo di ipertrofia e apoptosi regionale che avvia il processo di rimodellamento.
RECENTI VERIFICHE CLINICHE. Il legame già ipotizzato tra rimodellamento ventricolare e caratteristiche del flusso vorticoso è stato verificato in pazienti con scompenso sottoposti alla terapia di sincronizzazione cardiaca (CRT, pace-maker bi-ventricolare). Tutti i pazienti che hanno presentato una riduzione significativa dei volumi ventricolari presentano un allineamento dei gradienti pressori intra-cavitari; altresì, i pazienti che non rispondono alla terapia mostrano una dominanza di gradienti pressori trasversali.
L'improvvisa interruzione della stimolazione bi-ventricolare nei pazienti con un alto grado di risposta alla terapia dà luogo ad una condizione presumibilmente destinata a ricadere verso lo scompenso cardiaco nell’arco di poche settimane. In tale situazione, la meccanica ventricolare non mostra subito variazioni rilevabili dal punto di vista del movimento della parete endocardica. All’opposto, si riscontrano notevoli differenze dal punto di vista emodinamico, che risultano evidenti dall’analisi della distribuzione della quantità di moto, ovverosia dei gradienti pressori intraventricolari (Figura 2).
CONCLUSIONE. Il processo di adattamento del cuore a seguito di fenomeni acuti, tra cui rimodellamento avverso o inverso, dipende anche dalla qualità del flusso cardiaco che è destinato a divenire parte integrante dei futuri processi diagnostici nonché di ottimizzazione chirurgica.
---------------------------------------------------------------------------------------------------------------------------------
Figura 1. L'immagine descrive il vortice del flusso sanguigno attraverso il ventricolo sinistro. La tecnica ecocardiografica impiegata si basa sul tracciamento del mezzo di contrasto per visualizzare il flusso intracavitario (adattato dalla copertina di Nature Review Cardiology 2013).
Figura 2. Istogramma polare della distribuzione dei gradienti di pressione intra-ventricolari in un soggetto che ha risposto con un inversione del rimodellamento a seguito di terapia CRT mediante pace-maker bi-ventricolare (sinistra). Nella figura di destra lo stesso paziente pochi istanti dopo la disattivazione della terapia.
|
|